blog de cienciencias
viernes, 30 de agosto de 2019
semana #26
Clases de reactivos:
Radicales libres.
se producen en las reacciones homolíticas, son bastante reactivos e interaccionan con otros tipos de radicales o con moléculas de tipo neutro. Los radicales en química orgánica se llaman primarios, secundarios o terciarios, dependiendo de la naturaleza que tenga el carbono que cuente con el electrón no apareado. Los radicales terciarios son los que mças estabilidad poseen, y por lo tanto, son menos reactivos.

Reactivos electrófilos:
Son reactivos con alguno de sus átomos de poca densidad electrónica, por lo cual suelen actuar sobre los átomos del sustrato que tienen carga negativa, o una alta densidad de carga. Los reactivos electrófilos siempre son cationes u otras moléculas que tienen algún orbital atómico sin ocupar, como por ejemplo H+, BF3, SO3, etc.

Reactivos nucleófilos:
Son reactivos que tienen algunos de sus átomos con una alta densidad de carga, por lo que suelen actuar en los átomos del sustrato que tenfa carga positiva o un deficit de carga. Por lo general son aniones o neutros con electrones libres, por lo tanto, ceden electrones. Es el caso del H-, OH-, CN-, etc.

Principales tipos de reacciones orgánicas:
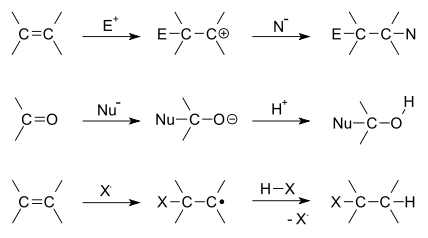
Reacciones de sustitución.
Son reacciones donde un átomo o varios átomos de un reactivo se meten en la cadena de carbonos que forma al sustrato, consiguiendo cambiar alguno de los átomos que se encuentran unidos al carbono.
R-X (sustrato) + Y ( reactivo) → R-Y + X
Según el tipo de ruptura que se cree en los enlaces, la sustitución podrá ser homolítica o heterolítica. La más frecuente es la sustitución heterolítica, la cual además puede ser nucleófila o electrófila (SN1, SN2, E1, o E2).
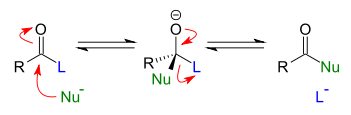
Reacciones de adición.
Se conocen como reacciones de adición a aquellas donde dos átomos que se encuentren unidos a través de enlaces dobles o triples, cuando se han roto, se unen a otros tipos de átomos a través de enlaces simples. Estas adiciones pueden ser nucleófilas o electrófilas.
semana # 25
Isomería Conformacional.
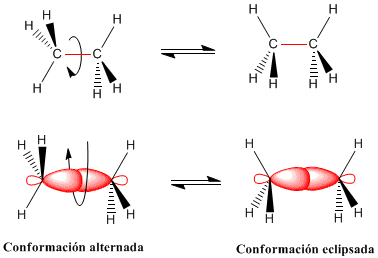
La libre rotación en torno a un enlace simple da lugar a que las moléculas puedan adoptar un número infinito de distribuciones espaciales interconvertibles recíprocamente sin ruptura de enlaces, debido a que entre los carbonos, se encuentra un enlace sencillo o sigma (σ). Estas disposiciones espaciales reciben el nombre genérico de conformaciones, y las distintas conformaciones reciben el nombre de confórmeros, Puede ser alternada o eclipsada, Sesgada o desviada: Se llaman así a las infinitas conformaciones que existen entre la alternada y la eclipsada. Su energía es mayor que la alternada y menor que la eclipsada.
La rotación del enlace carbono-carbono en el etano da lugar a dos conformaciones límite:
-El paso de la conformación alternada a la eclipsada o viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen infinitas conformaciones posibles.
semana #24
Isomería Óptica
Existen moléculas que coinciden en todas sus propiedades excepto en su capacidad de desviar el plano de luz polarizada. Son los llamados isómeros ópticos. Uno de ellos desvía la luz hacia la derecha, y se designa (+), o dextrógiro, mientas que el otro la desvía en igual magnitud pero hacia la izquierda, y se designa (-) o levógiro. El aparato que aparece en la foto de la derecha es un polarimetro
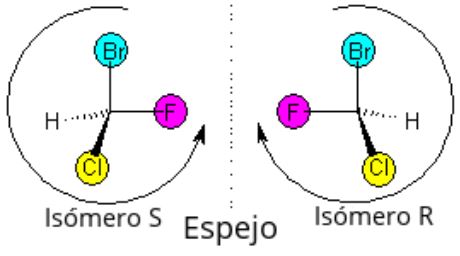
Su comportamiento frente a la luz polarizada se debe a que la molécula carece de plano de simetría, y por lo tanto se pueden distinguir dos isómeros que son cada uno la imagen especular del otro, como la mano derecha lo es de la izquierda.
Proyección de Fischer
La proyección de Fischer, ideada por el químico alemán Hermann Emil Fischer en 1891, es una proyección bidimensional utilizada en química orgánica para representar la disposición espacial de moléculas en las que uno o más átomos de carbono están unidos a 4 sustituyentes diferentes.

semana #23
Isomería Cis-Trans
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono. Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y el que los tiene a lados opuestos trans.

semana #21
Isómeros estructurales
Los isómeros estructurales son aquellos compuestos similares en formula molecular, pero que difieren en nomenclatura.
- Isómeros de cadena
Presentan misma formula molecular pero difieren en la cadena principal.

- Isómeros de posición
Los compuestos poseen fórmulas idénticas pero la posición de la función de la cadena cambia de carbono, en este caso la función alcohol cambia del carbono 2 al 3.

-Isómeros de función
Se los denomina de esta manera porque los compuestos pueden ser de distintos grupos funcionales sin embargo tienen la misma fórmula.

Suscribirse a:
Comentarios (Atom)
