
martes, 5 de marzo de 2019
semana #5
Práctica ejercicios ley de Dalton.
Una muestra de aire solo contiene nitrógeno y oxígeno gaseoso, cuyas presiones parciales son 0,80 atmósfera y 0,20 atmósfera, respectivamente. Calcula la presión total del aire.
· Primer paso: Identificar los datos que brinda el enunciado.
P(N)= 0,80 atm
P(O)= 0,20 atm
· Segundo paso: Conocer la incognita o interrogante.
Ptotal= ?
· Tercer paso: Sustituir los datos en la expresión matemática y efectuar el calculo.
Pt= P(N) + P(O)
Pt= 0,80 atm + 0,20 atm
Pt= 1 atm
2. Una muestra de gases contiene CH4, C2H6 y C3H8. Si la presión total es de 1,50 atm y la fracción molar de cada gas son 0.36; 0.294; 0.341; respectivamente. Calcular las presiones parciales de los gases.
· Primer paso: Identificar los datos que brinda el enunciado.
X(CH4)= 0,34
X(C2H6)= 0,294
X(C3H8)= 0,341
Ptotal= 1,50 atm
· Segundo paso: Conocer la incognita o interrogante.
P(CH4)= ?
P(C2H6)= ?P(C3H8)= ?
· Tercer paso: Sustituir los datos en la expresión matemática y efectuar los calculos.
Pparcial= X(gas) . Ptotal
P(CH4)= 0,34 . 1,50 atm= 0,51 atm
P(C2H6)= 0,294 . 1,50 atm= 0,196 atm
P(C3H8)= 0,341 . 1,50 atm= 0,512 atm
semana #4
Ley de Dalton, Presiones Parciales
Esta ley establece que, en una mezcla de gases los cuales no se combinan e interaccionan sus moléculas independientemente de si están los otros gases, dice que la presión de esa mezcla, es igual a las presiones ejercidas por esos gases sumadas(Presiones parciales).

Ejemplo:
Una muestra de aire solo contiene nitrógeno y oxígeno gaseoso, cuyas presiones parciales son 0,80 atmósfera y 0,20 atmósfera, respectivamente. Calcula la presión total del aire.
· Primer paso: Identificar los datos que brinda el enunciado.
P(N)= 0,80 atm
P(O)= 0,20 atm
· Segundo paso: Conocer la incognita o interrogante.
Ptotal= ?
· Tercer paso: Sustituir los datos en la expresión matemática y efectuar el calculo.
Pt= P(N) + P(O)
Pt= 0,80 atm + 0,20 atm
Pt= 1 atm
semana #3
En Esta semana vimos sobre los gases ideales y la ley de avogrado:
Esta ley establece el estado del gas ideal, el cual esta formado por partículas sin atracción o repulsión entre ellas, y cuyo choque es perfectamente elástico.
A temperatura constante, la presión de una masa fija de gas, es inversamente proporcional al volumen de este.

La temperatura usada en la ecuación, sería una temperatura absoluta, y esta a la vez es directamente proporcional a la presión y al volumen.

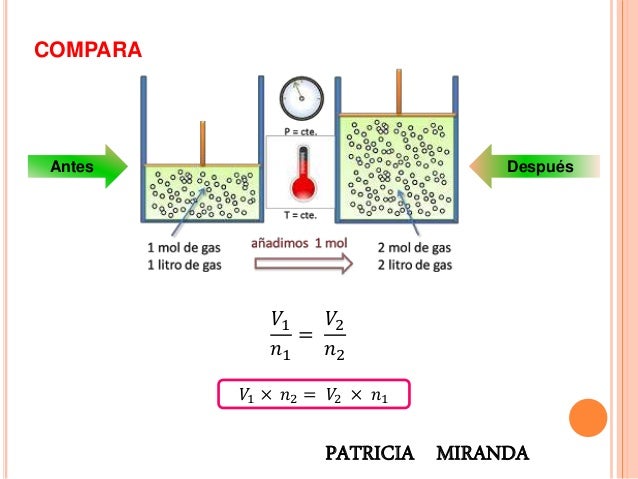
Esta ley relaciona la cantidad de gas con el volumen mismo a temperatura y presión constantes,
mientras más moles de gas tengamos, más volumen tendrá el gas.
La diferencia entre volumen y moles del gas es una constante, por lo que:

Ley de los gases ideales.
Esta ley establece el estado del gas ideal, el cual esta formado por partículas sin atracción o repulsión entre ellas, y cuyo choque es perfectamente elástico.
A temperatura constante, la presión de una masa fija de gas, es inversamente proporcional al volumen de este.

La temperatura usada en la ecuación, sería una temperatura absoluta, y esta a la vez es directamente proporcional a la presión y al volumen.
Ley de Avogadro.
Esta ley relaciona la cantidad de gas con el volumen mismo a temperatura y presión constantes,
mientras más moles de gas tengamos, más volumen tendrá el gas.
La diferencia entre volumen y moles del gas es una constante, por lo que:

semana #2
En Esta semana vimos algunas leyes de los gases
Boyle descubrió que a temperatura constante, la presión del gas es inversamente proporcional al volumen del mismo, planteó su descubrimiento con esta formula matemática.

Esto quiere decir, que si la presión en un gas aumenta, su volumen también lo hace, y viceversa.
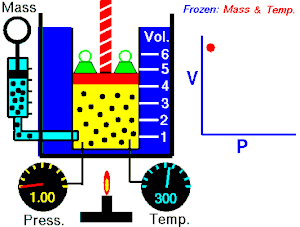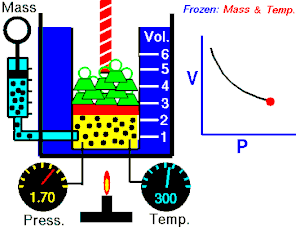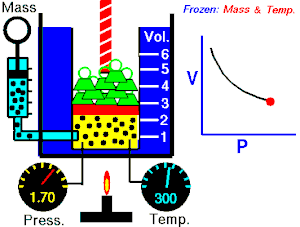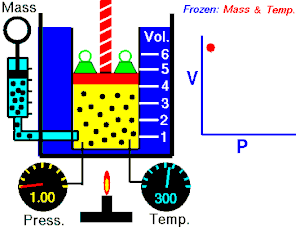
Esta ley dice que a presión constante, el volumen del gas es directamente proporcional a su temperatura si la presión es constante.


Ley de Boyle
Boyle descubrió que a temperatura constante, la presión del gas es inversamente proporcional al volumen del mismo, planteó su descubrimiento con esta formula matemática.
Esto quiere decir, que si la presión en un gas aumenta, su volumen también lo hace, y viceversa.

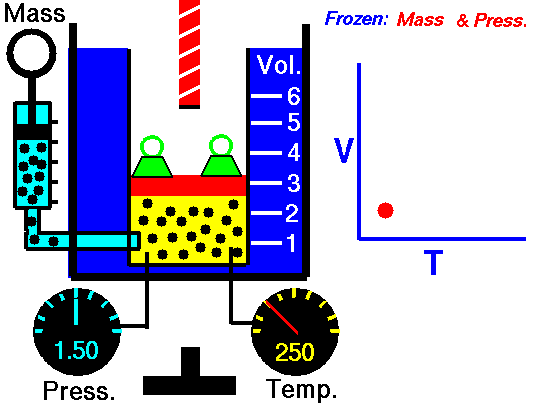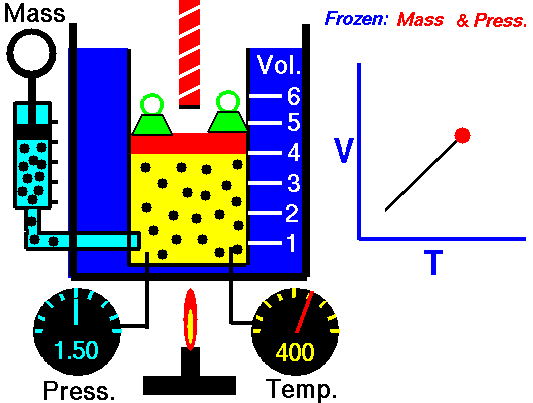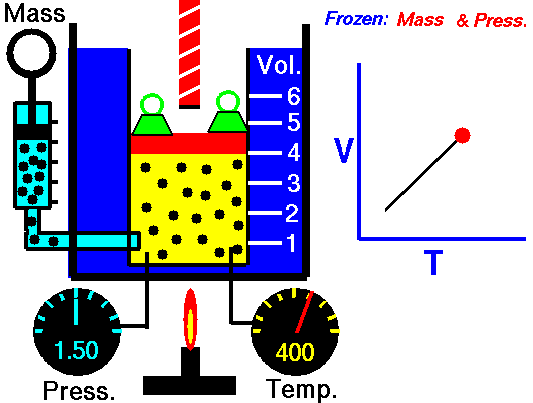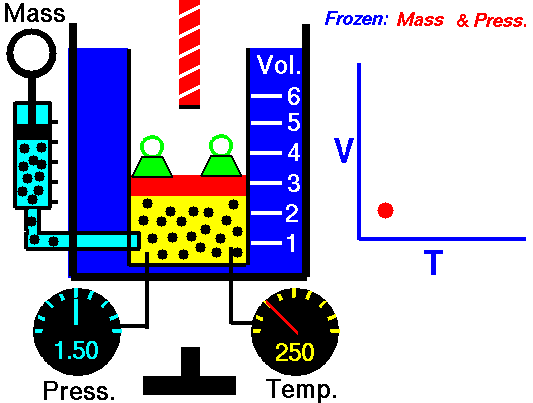
Ley de Charles
Esta ley dice que a presión constante, el volumen del gas es directamente proporcional a su temperatura si la presión es constante.
Esto quiere decir que si la temperatura sube, el volumen también lo hará.

Ley Combinada:
Esta ley que combina las 2 anteriormente vistas, establece que el volumen de un gas es directamente proporcional a la temperatura e inversamente proporcional a la presión en caso de que no haya ninguno constante.
semana #1
Actividad Inicial:
Gracias por un nuevo amanecer.
El señor nos ayudó, siempre nos ayudó y siempre nos ayudará, no solo en los momentos complicados en situaciones del mundo externo, si no que también cuando tenemos una adversidad interna que nos intenta hacer daño, nos ayuda siempre a ser felices, pero solo si nosotros lo deseamos.
Preguntas Periodo:
1. ¿Porqué se usan neveras de icopor con hielo y acerrín para transportar sustancaias que requieren mantenerse a bajas temperaturas?
2. ¿Cómo Influye la temperatura para los cambios de los cuerpos?

Temas a tratar:
- Configuración electrónica del carbono
- Geometría molecular
- Tipos de hibridaciones
- Diferencias entre fórmula empírica molécular y estructural
- Fórmula hetereoquímica
- Importancia de la Qca orgánica
- Elementos de la Qca orgánica
- Diferencia entre los compuestos orgánicos e inorgánicos
- Formas atrópicas del carbono
- Descubrimiento de los antibióticos
- Los Hidrocarburos
- El estado Gaseoso
- Propiedades y Características de los gases
- Leyes de los gases
- Aplicaciones de los gases
- Problemas de gases
Suscribirse a:
Comentarios (Atom)